Europäische Arzneimittel-Agentur bestätigt Todesfälle nach COVID-Impfung – im Kleingedruckten

Von Bernhard Loyen
Seit Mitte September 2023 konnte, also durfte das Mainzer Unternehmen BioNTech unter kollegialer Mithilfe und Erteilung des notwendigen Prüfsiegels der Europäischen Arzneimittel-Agentur (EMA) die jüngste und erneute Anpassung des an die Omikron-Variante XBB.1.5 angepassten COVID-19-mRNA-Impfstoffs ausliefern. Die Talfahrt der schwächelnden Aktie wurde damit kurzzeitig gestoppt. In der Pharmaindustrie geht es zwar auch um Gesundheit, bekannterweise aber eigentlich um die Erzielung von Milliardenumsätzen.
In der seit dem 24. Dezember 2020 regelmäßig modifizierten EMA-Veröffentlichung mit dem Namen "Anhang I: Zusammenfassung der Produktmerkmale" zum BioNTech Comirnaty-Produkt der Stunde steigerte sich die nachweisliche Seitenzahl von anfänglichen 32 Seiten bis zur jüngsten Aktualisierung im September 2023 auf beeindruckende 536 Seiten. Dafür gibt es mehr als bedenkliche, wenn nicht skandalöse Gründe.
Ab wann sollte daher ein Pharmaskandal als solcher nicht nur betrachtet, sondern auch entsprechend benannt werden? Welche Größenordnung nachweislicher Schädigungen von Menschen muss erreicht werden, die im Rahmen eines Vertrauensmoments zu den staatlichen und wissenschaftlichen Empfehlungen, Werbungen, Angaben und Erläuterungen eintraten, ehe ein Pharmaprodukt umgehend in seiner weiteren Verbreitung gestoppt und vom Markt genommen wird?

Warum verweigern weiterhin verantwortliche wissenschaftlich-politische Institutionen und Akteure die dringend benötigte Aufarbeitung eines fahrlässig auf den (Menschen-)Markt geworfenen Versuchsprodukts? Weil die politische Macht schwerer wiegt als die belegbare humane Katastrophe. Weil die unveränderte Machtposition der milliardenschweren Pharmaindustrie mehr erreichen kann als kritische Mahner und besorgte Politiker und Wissenschaftler. Ob in der kleinen oder großen Betrachtung ist dabei unwesentlich.
Was offenbart nun das verräterische Kleingedruckte in der jüngsten Veröffentlichung der EMA-Überprüfungsinstanzen? Blicken wir zuvor zurück zum 12. März dieses Jahres. Ein manisch wirkender, nachweislich skrupelloser und weiterhin unantastbarer Gesundheitsminister Karl Lauterbach gibt dem ZDF ein Interview. Unglaubwürdig versucht er, darin Empathie zu zeigen für die stetig steigende Zahl registrierter, ganze Biographien zerstörender Nebenwirkungen durch das BioNTech-Produkt. Es erfolgte der unglaubwürdige Satz:
"Die Menschen tun mir ehrlich gesagt auch sehr leid."
Der ZDF-Artikel bemerkt immerhin: "Lauterbach vermischt Begriffe, spricht mal von Impfschäden, mal von Nebenwirkungen, dann wieder von 'Post Vac'." Diese Vernebelungstaktik, das nebulöse, willkürliche Vermischen von dienlichen Formulierungen, ist die bewusste manipulative Strategie des Karl Lauterbach. Er wird den Inhalt der EMA-Veröffentlichungen kennen, kennen müssen. Gleichwohl besteht die Gefahr, dass er den "Anhang I" nur oberflächlich überflogen hat, sich etwa sogar von einem BMG-Mitarbeiter hat zusammenfassen lassen. Dies findet seinen Ausdruck in Lauterbachs regelmäßigen willkürlichen und gewagten X/Twitter-Studienempfehlungen zum Thema Corona.
Der zweite kurze Rückblick soll auf Emer Cooke fallen, die Direktorin der Europäischen Arzneimittel-Agentur (EMA). Im April 2021 informierte die Nachrichtenseite DWW über ihren beruflichen Werdegang:
"In der Zeit von 1985 bis 1988 war Cooke in verschiedenen Positionen in der irischen Pharmaindustrie tätig, bevor sie 1988 als pharmazeutische Gutachterin zur irischen Arzneimittelregulierungsbehörde wechselte. 1991 wechselte sie als Managerin für Wissenschaft und Forschung zu EFPIA, dem europäischen Verband der pharmazeutischen Industrie Regulierungsangelegenheiten in Brüssel."
EFPIA ist wiederum der europäische Dachverband der pharmazeutischen Industrie, dessen Mitglieder 33 nationale Verbände und 40 führende europäische Arzneimittelhersteller sind. Zu den Vollmitgliedern von EFPIA gehören unter anderem AstraZeneca und Johnson & Johnson. Diese Frau leitete und bestimmt(e) die Überprüfung neuartiger mRNA-Wirkstoffe ab dem Jahr 2020. Zuvor was sie ab 2016 Direktorin der Abteilung für Regulierung und Präqualifikation der WHO in Genf.
Diese Frau genehmigte dann auch im November 2020 das beschleunigte Zulassungsverfahren für das BioNTech-Produkt Comirnaty. Es folgte daraufhin die sogenannte "bedingte Zulassung" auch für den deutschen Markt im Dezember 2020.
Diese Frau ließ regelmäßig die Versionen der Zusammenfassung von "Produktmerkmalen" aktualisieren, ohne dass auffällige bis bedenkliche Neuerkenntnisse zu dem Produkt den gigantischen Milliardenumsatz des Uğur Şahin und seines Co-Partners Albert Bourla vom US-Unternehmen Pfizer je gefährdeten. Das Bild zeigt die Häufigkeiten von Neuformulierungen im Jahr 2021:
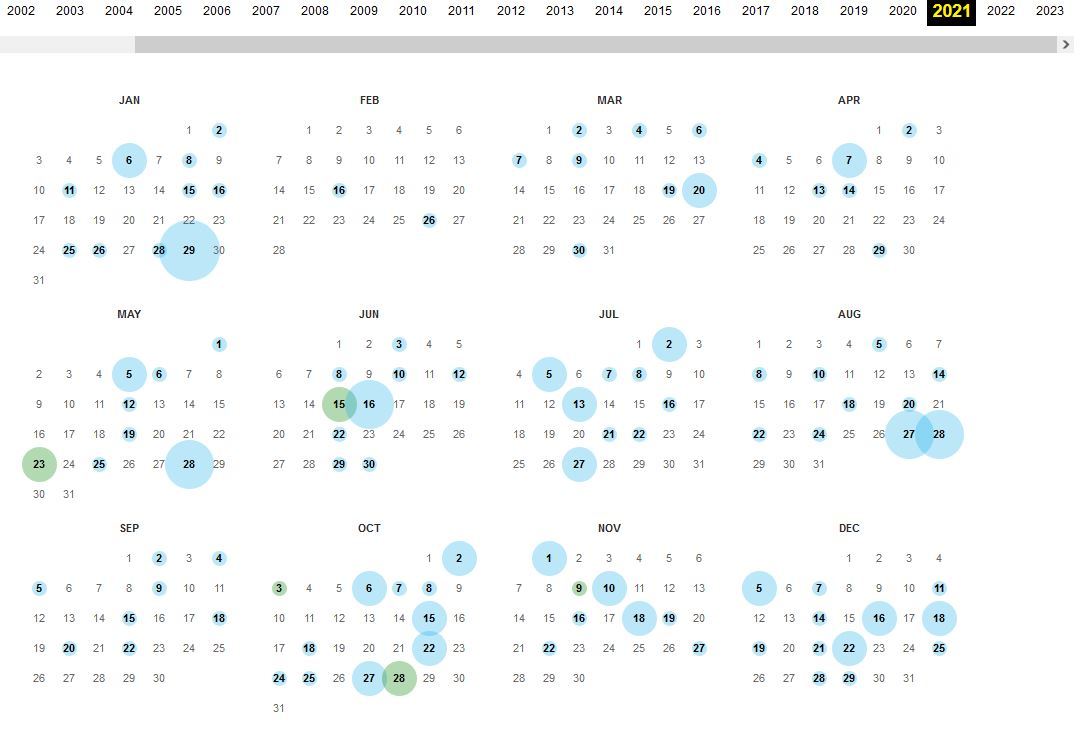
Die genaue Darstellung aller Umformulierungen sprengt den Rahmen dieses Artikels. Daher werden hier lediglich die Veränderungen in der Rubrik "4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für uns" herausgehoben. Bis Juli 2021 behandelte diese Unterrubrik die Thematik "Thrombozytopenie und Blutgerinnungsstörungen" (Seite 4). Thrombozytopenie bedeutet "eine Verminderung der Zahl der Blutplättchen (Thrombozyten), dadurch erhöht sich das Risiko für Blutungsereignisse". Ab dem 16. Juli 2021 lautete die Ergänzung auf Seite 3 (die Gesamtseitenzahl lag noch bei überschaubaren 36 Seiten):
"Sehr seltene Fälle von Myokarditis und Perikarditis wurden nach der Impfung mit Comirnaty beobachtet. Diese Fälle traten hauptsächlich innerhalb von 14 Tagen nach der Impfung auf, häufiger nach der zweiten Impfung und häufiger bei jüngeren Männern. Die verfügbaren Daten deuten darauf hin, dass sich der Verlauf von Myokarditis und Perikarditis nach der Impfung nicht von einer allgemeinen Myokarditis oder Perikarditis unterscheidet."
Also Ereignisse von Herzmuskelentzündungen oder einer Entzündung des Herzbeutels. Zudem die dringliche Aufforderung, dass "Angehörige der Gesundheitsberufe auf Anzeichen und Symptome von Myokarditis und Perikarditis achten sollten". Und weiter:
"Die Geimpften sollten angewiesen werden, sofort einen Arzt aufzusuchen, wenn sie Symptome entwickeln, die auf eine Myokarditis oder Perikarditis hinweisen, wie (akute und anhaltende) Brustschmerzen, Kurzatmigkeit oder Herzklopfen nach der Impfung."
Im Oktober erfolgte eine weitere Ergänzung: "Das Risiko einer Myokarditis nach einer dritten Dosis Comirnaty ist noch nicht beschrieben worden." Im November 2021 (70 Seiten Länge) hieß es dann: "Angehörige der Gesundheitsberufe sollten sich bei der Diagnose und Behandlung dieser Erkrankung an Berater und/oder Spezialisten wenden." Bezog sich diese Formulierung auch auf die Einrichtung von breit organisierten Impfzentren? Im Dezember (106 Seiten Länge) dann wieder eine auffällige Neuerung:
"Nach der Impfung mit Comirnaty besteht ein erhöhtes Risiko für Myokarditis und Perikarditis. Diese Erkrankungen können innerhalb weniger Tage nach der Impfung auftreten und sind am häufigsten innerhalb von 14 Tagen. Sie wurden häufiger nach der zweiten Impfung und häufiger bei jüngeren Männern beobachtet."
Von "Sehr seltenen Fällen" die belegte Steigerung zu "besteht ein erhöhtes Risiko". Die kaum wahrnehmbare Steigerung von "hauptsächlich innerhalb von 14 Tagen" zu "innerhalb weniger Tage". Die Geimpften – "einschließlich Eltern oder Betreuer" – sollten "angewiesen werden, sofort einen Arzt aufzusuchen". Ein Jahr später lag die Gesamtseitenzahl ohne weitere Umformulierungen zu diesem Thema dann bereits bei 276 Seiten. Im Juli des Jahres 2023 sind es 278 Seiten, bevor im September, nach dem jüngsten EMA-Ergebnis der Analysen, dass auch die aktuelle Anpassung auf den saisonalen COVID-Markt freigegeben werden kann, die nun auffälligste, wenn nicht skandalöse Information. In der Version vom 14. September und der absurden Steigerung auf 536 Seiten heißt es wörtlich (Seite 4):
"Es besteht ein erhöhtes Risiko für Myokarditis und Perikarditis nach einer Impfung mit Comirnaty. Diese Erkrankungen können innerhalb weniger Tage nach der Impfung auftreten und sind hauptsächlich innerhalb von 14 Tagen aufgetreten. Sie wurden häufiger nach der zweiten Impfung und häufiger bei jüngeren Männern beobachtet.
Die verfügbaren Daten deuten darauf hin, dass sich die meisten Fälle erholen.
Einige Fälle erforderten intensivmedizinische Pflege, zudem wurden tödliche Fälle beobachtet."
Der Hinweis zu möglichen Risiken "nach einer dritten Dosis Comirnaty" wurde entfernt. Zusammenfassend lässt sich sagen: Weder die Presseabteilung der EMA, der WHO, des in Deutschland zuständigen Paul Ehrlich-Instituts, des BMG noch Karl Lauterbach sahen anscheinend die Notwendigkeit diese Information weiterzugeben. Das Gleiche gilt für den hauptverantwortlichen BioNTech-Chef Uğur Şahin. Die deutsche Medienlandschaft schweigt, inklusive der wissenschaftlichen Redaktionen. Die Empfehlungen zu einer erneuten "Auffrischungsimpfung" – was von der Begrifflichkeit her falsch ist, da es sich ja um eine neue, "angepasste" Version eines Wirkstoffs handelt – wird breiter publiziert.
Nicht weniger skandalös ist die Tatsache, dass der "Durchführungsbeschluss der EU-Kommission vom 29. August 2023" dieses unfassbare Detail kannte und nicht reagierte, sondern die deutsche Version auf seiner Webseite zur Verfügung stellte (Seite 4):
"In einigen Fällen war eine intensivmedizinische Versorgung erforderlich, und es wurden Fälle mit Todesfolge beobachtet."
Die mehr als berechtigte Frage muss daher lauten: Warum wird ein mehr als kritikwürdiges Pharmaprodukt, mit nun offiziell nachweislich tödlichen Nebenwirkungen, nicht umgehend vom Markt genommen? Alle Auslieferungen gestoppt und Herr Şahin zum umgehenden Rapport nach Berlin bestellt?
Welche unbekannten Abgründe, mögliche Erklärungen, sich noch auf den anderen 535 Seiten finden werden, etwa zu den Themen Schwangerschaftsirritationen und Fruchtbarkeit, Auffälligkeiten von bedenklichen Phänomenen im Bereich der Krebs-Diagnostik, der Dermatologie (Heilkunde für Hautkrankheiten) und weiteren medizinischen Feldern, lässt schlussendlich die Begrifflichkeit "Pharmaskandal" als eindeutig zu schwach erscheinen.
Mehr zum Thema - Mehrere Klagen von Corona-Impfgeschädigten gegen die Bundesregierung
RT DE bemüht sich um ein breites Meinungsspektrum. Gastbeiträge und Meinungsartikel müssen nicht die Sichtweise der Redaktion widerspiegeln.
Durch die Sperrung von RT zielt die EU darauf ab, eine kritische, nicht prowestliche Informationsquelle zum Schweigen zu bringen. Und dies nicht nur hinsichtlich des Ukraine-Kriegs. Der Zugang zu unserer Website wurde erschwert, mehrere Soziale Medien haben unsere Accounts blockiert. Es liegt nun an uns allen, ob in Deutschland und der EU auch weiterhin ein Journalismus jenseits der Mainstream-Narrative betrieben werden kann. Wenn Euch unsere Artikel gefallen, teilt sie gern überall, wo Ihr aktiv seid. Das ist möglich, denn die EU hat weder unsere Arbeit noch das Lesen und Teilen unserer Artikel verboten. Anmerkung: Allerdings hat Österreich mit der Änderung des "Audiovisuellen Mediendienst-Gesetzes" am 13. April diesbezüglich eine Änderung eingeführt, die möglicherweise auch Privatpersonen betrifft. Deswegen bitten wir Euch bis zur Klärung des Sachverhalts, in Österreich unsere Beiträge vorerst nicht in den Sozialen Medien zu teilen.